Instruks
Formål:
Beskrive neurologisk prognosticering af genoplivede hjertestoppatienter med manglende opvågning.
Forkortelser:
SSEP: SomatoSensorisk Evokerede Potentialer
GPDs: Generaliserede Periodiske Discharges
ROSC: Return Of Spontaneous Circulation
Vurdering af patientens prognose bør tidligst foretages 72 timer efter genoplivning og kun på patienter, som med sikkerhed ikke længere er påvirket af sedativa eller andre reversible metaboliske årsager til bevidsthedspåvirkning. Prognosticering bør være multimodal og udføres mhp. beslutning om ophør af livsforlængende behandling. Parakliniske undersøgelser som led i prognosticering bør derfor kun bestilles ved fortsat dyb bevidstløshed, herunder intet eller kun reflektorisk motorrespons, hos den usederede patient. Er disse forhold ikke til stede, bør afventes for yderligere tegn på opvågning.
Prognostiske faktorer:
Præhospitale prognostiske faktorer associeret med god prognose:
- Bevidnet hjertestop
- Hjerte-lunge-redning opstart før ambulancens ankomst
- Kort responstid til ankomst af ambulance
- Ventrikelflimmer som første registrerede rytme
- Lav alder
Ingen af disse faktorer kan dog sikkert forudsige hverken god eller dårlig prognose for den enkelte patient.
Klinisk undersøgelse
Neurologisk undersøgelse af komatøse hjertestopoverlevere fokuserer på hjernestammefunktion (lys-, cornea- og oculocephale reflekser) samt bevidsthedsniveau. Herunder er det specielt det motoriske respons, som det vurderes i Glasgow Coma Scale eller FOUR score (Full Outline of UnResponsiveness), navnlig reaktion på smertestimuli centralt og perifert. Herudover bør observeres for hosterefleks/respons på sugning samt respiratorisk drive, asymmetri i facialis muskulatur samt tonus, refleksforhold og eventuel øjendrejning, som kan indikere mere fokal cerebral skade eller epileptiske anfaldsfænomener. Desuden vurderes tilstedeværelse af myoklonier.
Den neurologiske undersøgelse med henblik på prognosticering foretages tidligst 72 timer efter genoplivning. Der bør som udgangspunkt være forløbet mindst 24 timer efter ophørt sedation (længere for midazolam eller ved påvirket nyrefunktion, kortere for kortvirkende opioider som fentanyl/remifentanyl).
Prædiktorer for dårlig prognose ved klinisk undersøgelse:
- Manglende pupil lysreflekser eller corneareflekser tre dage efter genoplivning, når patienten med sikkerhed ikke længere er påvirket af sedativa, er robuste faktorer for dårlig prognose. (Der er dog for begge beskrevet enkelte falsk positive)
- Manglende motorisk respons eller decerebreringsrigiditet er associeret med dårlig prognose, men med betydeligt højere falsk positiv rate. Manglende motorisk repons, dekortikerings- eller decerebreringsrigiditet (M≤3 GCS / M≤2 FOUR score) anbefales anvendt som kriterium for udvælgelse af patienter til prognosticering, men anbefales ikke tillagt selvstændig vægt ved den multimodale prognosticering.
- Tidlig og vedvarende (>30 min) generaliseret myoklon status er stærkt associeret med dårlig prognose. Der er dog beskrevet tilfælde med god prognose til trods for tidlige myoklonier, hvilket typisk har været hos patienter med primær hypoxisk årsag til hjertestop, hvor myoklonierne har været en del af et Lance-Adams syndrom
EEG
Ved klinisk mistanke om status epilepticus (SE) og ved opfølgning af behandling af SE kan EEG om praktisk muligt udføres på ethvert tidspunkt i forløbet.
Nyere studier har vist, at timingen af EEG optagelsen har stor betydning for den prognostiske værdi og at EEG tidligt i forløbet, selv under let sedering, kan anvendes prognostisk. Foreløbig anbefales dog, at der er forløbet mindst 24 timer efter return of spontaneous circulation (ROSC), og at patienten er uden indflydelse af sedativa før prognostisk EEG foretages.
EEG mønstre utvetydigt associeret med en dårlig prognose:
- Suppression (<10 μV)
- Synkrone mønstre med ≥ 50% suppression
- Burst-Suppression med generaliserede abrupt startende bursts på supprimeret baggrund (inkluderer Burst-Suppression med identiske bursts og stærkt epileptiforme bursts)
- Generaliserede periodiske discharges (GPD) på supprimeret baggrund
EEG mønstre associeret med en god prognose:
- Kontinuerlig eller næsten kontinuerlig aktivitet (Delta, Theta og Alpha)
- Tilstedeværelse af EEG reaktivitet
EEG mønstre som ikke med sikkerhed kan udsige prognosen:
- Low voltage (10- 20µV)
- Epileptiform inklusive status epilepticus (se nedenfor)
- Burst-Suppression heterogent mønster (kan være pga. sedation)
- Diskontinuerligt
Der er beskrevet god prognose efter behandling af SE hos patienter, som typisk var karakteriseret ved andre favorable faktorer (baggrundsaktivitet, EEG reaktivitet, bevaret N20 respons på SSEP eller bevarede hjernestammereflekser). SE på EEG anbefales derfor altid forsøgt behandlet. GPDs med frekvens 0,5 – 2,5 Hz uden evolution/fluktuation på en supprimeret baggrund betragtes dog som udgangspunkt ikke som SE, men som tegn på anoxisk encefalopati.
Somatosensorisk evokerede potentialer (SSEP)
Bilateralt manglende N20 respons på SSEP med samtidigt bevaret C7 respons er en robust prædiktor for dårlig prognose. SSEP påvirkes i mindre grad end EEG af sedativa. Undersøgelse bør tidligst foretages 24 timer efter ROSC og gerne senere.
Billeddannende undersøgelser
- MR af cerebrum: Kan ved store iskæmiske læsioner bruges som beslutningsstøtte. Desuden vil differential diagnostiske årsager til bevidsthedstab såsom bilaterale thalamus infarkter, sinus rectus trombose, multiple bilaterale embolier med videre kunne udelukkes
- CT af cerebrum: Kan anvendes differential diagnostisk tidligt i forløbet med henblik på udelukkelse af intracerebral hæmorhagi eller anden intracerebral årsag til koma. Generaliseret cerebralt ødem synligt på CT af cerebrum senere i forløbet vil også være anvendeligt som beslutningsstøtte i den samlede vurdering
Biomarkører
Neuron Specifik Enolase (NSE) kan anvendes som beslutningsstøtte, forudsat normalværdier og grænseværdier for dårlig prognose er validerede på lokal biokemisk afdeling grundet variabilitet mellem målemetoder. Vejledende er værdier >60µg/l mere end 48 timer efter genoplivning stærkt associeret med dårlig prognose mens værdier >100µg/l utvetydigt indikerer dårlig prognose (hæmolyse skal være udelukket).
Beslutningsstrategi
Der er ikke nogen af de ovenfor beskrevne prognostiske faktorer, som med absolut sikkerhed kan forudsige død eller vegetativ tilstand. Blandt de patienter, som genvinder bevidsthed, sker det hos op til en tredjedel senere end 48 timer efter ophør af sedation og er beskrevet op til 14 dage efter genoplivning. Høj alder, shock og nyrepåvirkning er associeret med sen opvågning. En multimodal tilgang anbefales, hvor mindst to robuste ikke-favorable prognostiske faktorer lægges til grund for en beslutning om at indstille behandling. Mindst 72 timer efter genoplivning er sådanne robuste faktorer manglende hjernestamme (pupil og cornea) reflekser, bilateralt manglende kortikalt SSEP-respons, EEG mønstre utvetydigt associeret med dårlig prognose, NSE værdi over lokalt valideret grænseværdi, tidlig og vedvarende generaliseret myoklon status og udbredte hypoxisk-iskæmiske læsioner på MR eller CT. Er kun en af disse til stede anbefales at afvente og løbende reevaluere. Det skal bemærkes, at andre faktorer kan inddrages i beslutningen om evt. behandlingsophør. Herunder komorbiditet, alder, livstestamente, svigt af andre organer mv.
Beslutningsstrategi skitseret:
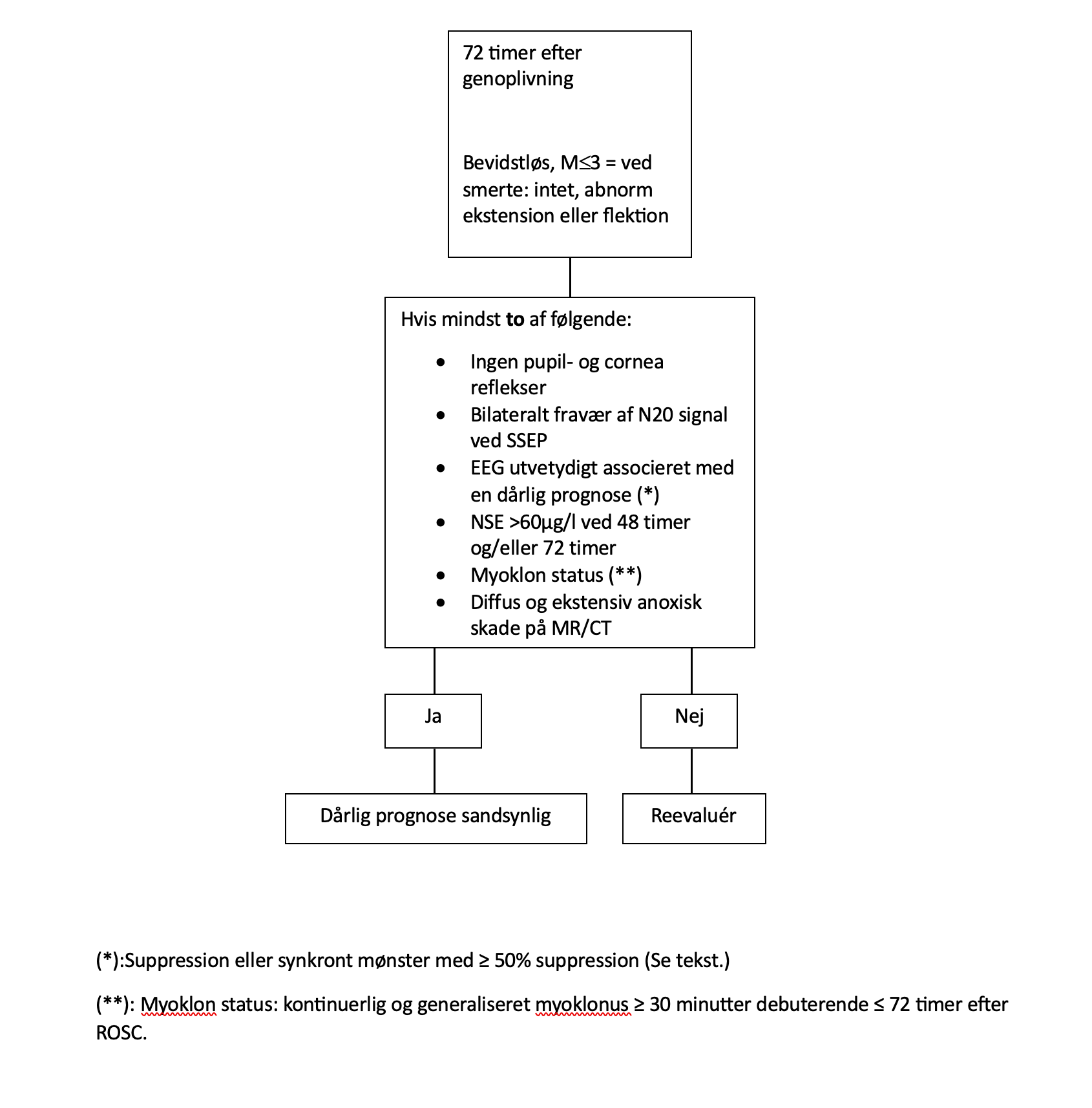
Behandling af myoklonier:
En hyppig årsag til henvendelse fra intensiv afdeling. Er der tvivl om hvorvidt der er tale om status epilepticus, bør man behandle på denne mistanke og bestille et diagnostisk EEG. Hvis EEG har afkræftet epileptiske anfald, eller man er klinisk sikker på, at der er tale om subkortikalt udløste myklonier da:
Overvej ingen behandling. Behandling er ofte ikke effektiv og kun symptomatisk. Hvis der er tale om gener i forbindelse med pleje eller for plejepersonale/pårørende kan forsøges:
- Levetiracetam 1000 mg x2. Kan øges til 1500 mg x2. Obs dosisreduktion ved nedsat nyrefunktion
- Clonazepam 0,5-1 mg. Ved god effekt evt. fast dosering x4
- Valproat fx 900 mg x1, kan øges til 1500 mg x2
Referencer:
- Nolan, J. P. et al. (2021). European Resuscitation Council and European Society of Intensive Care Medicine Guidelines 2021: Post-resuscitation Care
- Nolan, J. P. et al. (2015). European Resuscitation Council and European Society of Intensive Care Medicine Guidelines for Post-resuscitation Care 2015. Resuscitation, 95, 202–222. doi:10.1016/j.resuscitation.2015.07.018
- Wijdicks EF et al. Neurology 2006;67:203-10
- Nielsen N et al. N Engl J Med 2013;369:2197-206
- Paul M et al. Intensive Care Med (2016) 42:1128–1136
- Ruijter, B. J. et al. Early electroencephalography for outcome prediction of postanoxic coma: A prospective cohort study. Annals of neurology 86, 203–214 (2019)
Senest revideret d. 08.05.2023
Forfattere: Niels Sanderhoff Degn og Claus Z. Simonsen
Referenter: Birger Johnsen og Annette Sidaros
Godkender: Claus Z. Simonsen, redaktionsgruppe C
Keywords: SSEP, myoklonier, EEG, prognisticering, hjernedød
